がん治療ワクチン
1.ネオ抗原とmRNAワクチン
がん細胞にはがん化の過程で多くの体細胞遺伝子の突然変異が蓄積している。これらの変異した遺伝子の産物(タンパク質)は、細胞質内で変異のない産物と同様にプロテアソームによる分解を受け、MHCクラスI分子に結合し、MHC-抗原ペプチド複合体として細胞表面に提示される。これらの抗原ペプチドの中で遺伝子変異由来の配列を含むペプチドは、生来の変異のないペプチドと異なるため、細菌やウイルスなどの非自己抗原と同じく免疫寛容の対象とならず、ネオ抗原として免疫原性を有し、細胞障害性のCD8陽性T細胞の標的となる。
次世代シークエンス解析(NGS)の登場によりヒトゲノムの解読が容易となり、個々の患者の腫瘍の全エクソンシーケンスが可能となり、シークエンス解析の結果からMHC結合予測アルゴリズムを用いてMHCクラスI分子に結合するペプチド(エピトープ)の予測が可能となった。この様なNGSとバイオインフォマティクスの急速な進歩の恩恵を受け、個々の患者のネオ抗原をin silicoで予測することが可能となった。これにmRNAワクチン技術を組み合わせものが、究極の個別化医療であるmRNAネオ抗原ワクチンである(下図1に一般的なネオ抗原mRNAワクチンの製造スキームを示す)。
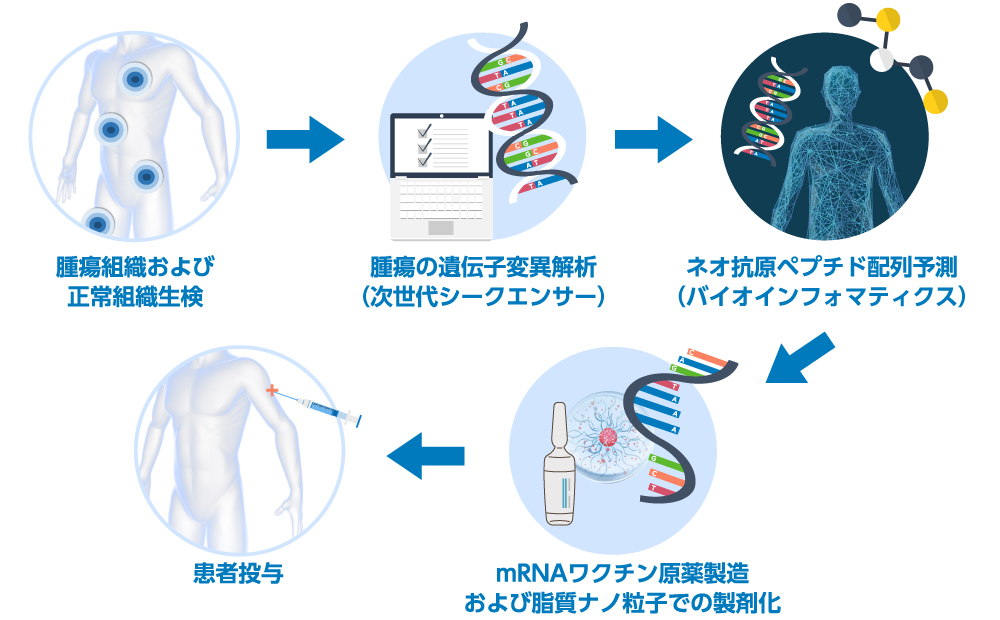
2.mRNAを用いたがん治療ワクチン
がんネオ抗原ワクチンの臨床開発を積極的に進めているのはModerna社およびBioNTech社の2大mRNAバイオテックである。
Moderna社は平均34個のネオ抗原をコードするmRNAから成るLNP製剤mRNA-4157を、BioNTech社は20個までのネオ抗原をコードするmRNAから成るPolyplex製剤Autogene cevumeran(BNT122)を開発している。両剤は既に単剤での安全性確認するFirst-in-human Phase I試験において、投与された幾つかのmRNA由来のネオ抗原に対するCD8陽性T細胞の誘導が確認されており、単剤のPOCが確立されている。
- mRNA-4157はメラノーマの術後アジュバント治療でイムノチェックポイント阻害抗体pembrolizumabとの併用ランダム化Phase II試験において、pembrolizumab単独に比べて有意な無再発生存期間の延長を示し※、Phase III試験に進んでいる。
- BNT122については、すい臓がんの術後アジュバント治療でイムノチェックポイント阻害抗体atezolizumabおよび標準療法(化学療法)とBNT122を併用した群の中で、ネオ抗原特異的なCD8陽性CTL誘導が見られた患者のみに顕著な無再発生存期間の延長傾向が見られることが確認されている。
これらの成績は、がん免疫療法で既に革新を起こしており、承認に向けた臨床試験結果が注目される。
表1 臨床開発に進んでいるネオ抗原mRNAワクチン
※2023.07.25 弊社WEBサイト記事『メルクとモデルナが、ネオ抗原mRNAがんワクチンの第三相試験を開始』参照
